MagSi-STA - Bead trifft Streptavidin .
Magnetische Partikel sind ideal als feste Trägerphase für Immunoassays. Sie ermöglichen vereinfachte Workflows und automatisierte Abläufe.
Unsere superparamagnetischen MagSi-STA Silica Beads sind mit einem modifzierten Streptavidin beschichtet. Dadurch eignen sie sich hervorragend zur Aufreinigung oder dem Capture von biotinylierten Molekülen.
Hard Facts .
- Streptavidin-gekoppelte magnetische Beads
- Hohe Bindungskapazität von bis zu 6800 pmol Biotin/mg Beads
- Einfaches Handling
- Kurzes und schnelles Protokoll
- Geringe unspezifische Interaktionen
- Unterschiedliche Bead-Größen verfügbar

Anwendungen .
MagSi-STA Beads sind perfekt für das Capturing von biotinylierten Molekülen. An die Beads gebundene Moleküle können durch einfache Protokolle aus der Probe entfernt bzw. aufgereinigt werden.
Die MagSi-STA Beads eignen sich hervorragend als feste Trägerphase von Immunoassays. In “Sandwich-Assays” können z.B. Antigene oder biotinylierte Antikörper sehr spezifisch nachgewiesen werden.
Schmalenberg, M., Beaudoin, C., Bulst, L., Steubl, D., & Luppa, P. B. (2015). Magnetic bead fluorescent immunoassay for the rapid detection of the novel inflammation marker YKL40 at the point-of-care. Journal of Immunological Methods, 427, 36–41. https://doi.org/10.1016/j.jim.2015.09.004
Bei der Erstellung von Genexpressionsprofilen mittels RNA-Seq muss störende rRNA entfernt werden. Zur dieser “Abreicherung” verwendet man sequenzspezifische biotinylierte Oligonukleotide, die an Strepdavidin-Beads wie z.B. MagSi-STA 600 BI binden. Diese lassen sich dann einfach per Magnet aus dem Reaktionsansatz entfernen.
Auch Antigene lassen sich elegant und sehr spezifisch mit biotinylierten Antikörpern einfangen. Die entstehenden Antigen-Antikörper-Komplexe binden an Streptavidin-gekoppelte Beads und können dann einfach und schnell aufgereinigt bzw. aufkonzentriert werden.
Das Abfischen von bestimmten Zellen zur weiterführenden Zelllinien-Analyse wird durch Magnetic Beads erheblich vereinfacht. Dazu mischt man Zellen mit Zelllinien-spezifischen, biotinylierten Antikörpern und fischt sie dann mit Streptavidin gekoppelten MagSi-STA ab.
Wirth, F., Huck, K., Lubosch, A., Zoeller, C., Ghura, H., Porubsky, S., & Nakchbandi, I. A. (2021). Cdc42 in osterix-expressing cells alters osteoblast behavior and myeloid lineage commitment. Bone, 153, 116150. https://doi.org/10.1016/j.bone.2021.116150
Details .
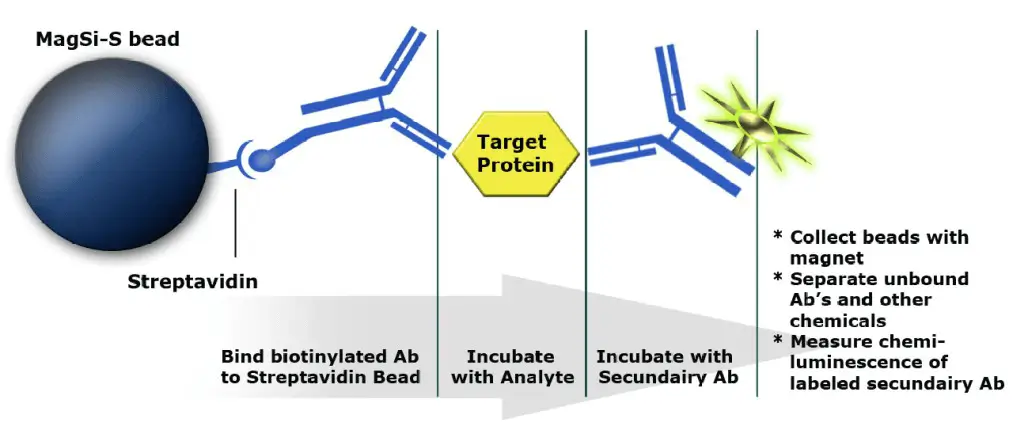
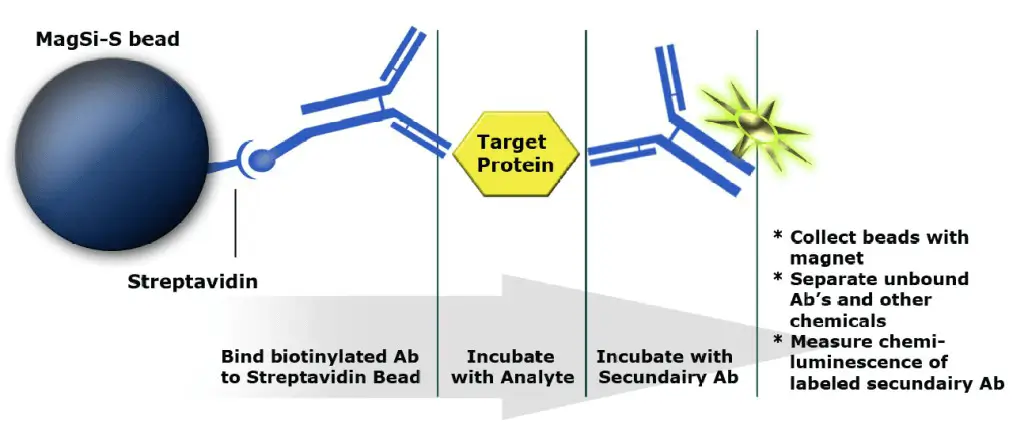
Magnetic Beads als feste Phase in Immunoassays .
Sandwich-Assay zum Nachweis von Antigenen:
- Biotinylierter Antikörper bindet an Bead (feste Phase)
- Target Protein / Antigen bindet an Antikörper und wird so aus der Lösung gefischt
- Sekundärer Antikörper mit Reporter (HRP) bindet an Target / Antigen. Der Komplex lässt sich dann über das chemiluminiszente Signal des Reporters detektieren.
MagSi-STA .
MagSi-STA Beads gibt es in zwei Typen mit unterschiedlicher Streptavidin-Kopplungschemie.
Carboxyl (C) gekoppelte Beads – mit zusätzlichem Spacer – eignen sich für Anwendungen, die eine eher hydrophile Oberfläche benötigen.
Tosyl (T) gekoppelte Beads sind optimiert für Anwendungen, die eine eher hydrophobe Oberfläche erfordern.
| Produkt | Kopplungschemie | Konzentration | Größe | Bindungskapazität (pmol Biotin/mg Beads) |
|---|---|---|---|---|
| MagSi-STA 600 | Carboxyl | 10 mg/ml | 600 nm | 3500-5000 |
| MagSi-STA 600 BI | Carboxyl | 10 mg/ml | 600 nm | 6000-6800 |
| MagSi-STA 1.0 | Carboxyl | 10 mg/ml | 1,0 µm | 3500-5000 |
| MagSi-STA 1.0 L | Carboxyl | 10 mg/ml | 1,0 µm | 1200-2000 |
| MagSi-STA 3.0 L | Carboxyl | 10 mg/ml | 3,0 µm | 700-1200 |
| MagSi-STA 1.0 TL | Tosyl | 10 mg/ml | 1,0 µm | 1200-2000 |
| MagSi-STA 1.0 TS | Tosyl | 10 mg/ml | 1,0 µm | 3500-5000 |
| MagSi-STA 3.0 TL | Tosyl | 10 mg/ml | 3,0 µm | 500-900 |
Capture und Abreicherung biotinylierter Proteine .
Das Capturing biotinylierter Moleküle mittels MagSi-STA Magnetic Beads ist supereinfach. Das Protokoll besteht lediglich aus drei Schritten: Bind, Wash, Elute.

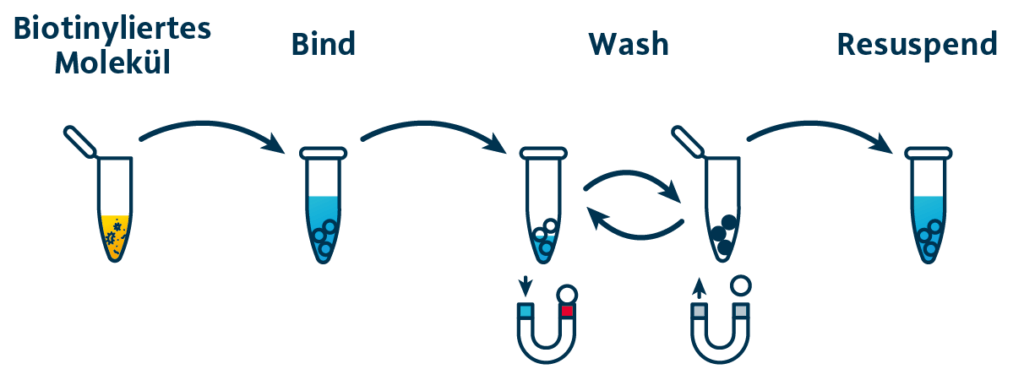
Die MagSi-STA Magnetic Beads mit Oberflächen-gebundenem Streptavidin werden der Lösung mit dem biotinylierten Analyten zugegeben. Nach einer kurzen Inkubation werden die Beads durch Magnete gesammelt, mehrmals gewaschen und resuspendiert.
MagSi-STA Beads mit Carboxyl Kopplung .
MagSi-STA Beads gibt es in zwei verschiedenen Typen – abhängig von der Streptavidin-Kopplungschemie. Carboxyl-gekoppelte Beads – mit zusätzlichem Spacer- eignen sich für Anwendungen, die eine eher hydrophile Oberfläche benötigen.
| Volumen | Produkt | Konzentration | Größe | Bindungskapazität (pmol Biotin/mg Beads) | |
|---|---|---|---|---|---|
| MD16001 | 2 ml | MagSi-STA 600 | 10 mg/ml | 600 nm | 3500-5000 |
| MD18001 | 10 ml | ||||
| MD19001 | 100 ml | ||||
| MD21001 | 2 ml | MagSi-STA 600 BI | 10 mg/ml | 600 nm | 6000-6800 |
| MD31001 | 10 ml | ||||
| MD41001 | 100 ml | ||||
| MD01001 | 2 ml | MagSi-STA 1.0 | 10 mg/ml | 1.0 µm | 3500-5000 |
| MD03001 | 10 ml | ||||
| MD04001 | 100 ml | ||||
| MD06001 | 2 ml | MagSi-STA 1.0 L | 10 mg/ml | 1.0 µm | 1200-2000 |
| MD07001 | 10 ml | ||||
| MD08001 | 100 ml | ||||
| MD33001 | 2 ml | MagSi-STA 3.0 L | 10 mg/ml | 3.0 µm | 700-1200 |
| MD34001 | 10 ml | ||||
| MD35001 | 100 ml |
MagSi-STA Beads mit Tosyl Kopplung .
MagSi-STA Tosyl-Beads sind optimal für Anwendungen, die eine hydrophobe Oberfläche erfordern.
| Artikelnummer | Volumen | Produkt | Konzentration | Größe | Bindungskapazität (pmol Biotin/mg Beads) |
|---|---|---|---|---|---|
| MD25001 | 2 ml | MagSi-STA 1.0 TL | 10 mg/ml | 1.0 µm | 1200-2000 |
| MD26001 | 10 ml | ||||
| MD27001 | 100 ml | ||||
| MD29001 | 2 ml | MagSi-STA 1.0 TS | 10 mg/ml | 1.0 µm | 3500-5000 |
| MD30001 | 10 ml | ||||
| MD31001 | 100 ml | ||||
| MD37001 | 2 ml | MagSi-STA 3.0 TL | 10 mg/ml | 3.0 µm | 500-900 |
| MD38001 | 10 ml | ||||
| MD39001 | 100 ml |
MagSi-STA Beads .
Erhältlich in den Größen 600 nm, 1,0 µm und 3,0 µm mit Carboxyl- oder Tosyloberfläche.
Downloads .
Martin, J. G., Gupta, M., Xu, Y., Akella, S., Liu, J., Dordick, J. S., & Linhardt, R. J. (2009). Toward an artificial Golgi: redesigning the biological activities of heparan sulfate on a digital microfluidic chip. Journal of the American Chemical Society, 131(31), 11041–11048. https://doi.org/10.1021/ja903038d
Schmalenberg, M., Beaudoin, C., Bulst, L., Steubl, D., & Luppa, P. B. (2015). Magnetic bead fluorescent immunoassay for the rapid detection of the novel inflammation marker YKL40 at the point-of-care. Journal of Immunological Methods, 427, 36–41. https://doi.org/10.1016/j.jim.2015.09.004
Chicher, J., Simonetti, A., Kuhn, L., Schaeffer, L., Hammann, P., Eriani, G., & Martin, F. (2015). Purification of mRNA-programmed translation initiation complexes suitable for mass spectrometry analysis. Proteomics, 15(14), 2417–2425. https://doi.org/10.1002/pmic.201400628
Martin, F., Ménétret, J.-F., Simonetti, A., Myasnikov, A. G., Vicens, Q., Prongidi-Fix, L., Natchiar, S. K., Klaholz, B. P., & Eriani, G. (2016). Ribosomal 18S rRNA base pairs with mRNA during eukaryotic translation initiation. Nature Communications, 7, 12622. https://doi.org/10.1038/ncomms12622
Shah, T., Qin, S., Vashi, M., Predescu, D. N., Jeganathan, N., Bardita, C., Ganesh, B., diBartolo, S., Fogg, L. F., Balk, R. A., & Predescu, S. A. (2018). Alk5/Runx1 signaling mediated by extracellular vesicles promotes vascular repair in acute respiratory distress syndrome. Clinical and Translational Medicine, 7(1), 19. https://doi.org/10.1186/s40169-018-0197-2
Wirth, F., Huck, K., Lubosch, A., Zoeller, C., Ghura, H., Porubsky, S., & Nakchbandi, I. A. (2021). Cdc42 in osterix-expressing cells alters osteoblast behavior and myeloid lineage commitment. Bone, 153, 116150. https://doi.org/10.1016/j.bone.2021.116150