
Funktionelle Beads .
Hard Facts .
- Unterschiedliche Oberflächenmodifikationen
- Kopplung von Proteinen, Peptiden, Antikörpern, Nukleinsäuren
- Einfaches Kopplungsprotokoll
- Verschiedene Bead-Größen verfügbar
- Leicht automatisierbar

Anwendungen .
Unsere MagSi-S COOH-Beads mit Carboxyl-Oberfläche eignen sich sehr gut zur Anreicherung von Metallen in flüssigen Proben. Zur Analyse lassen sich die Metalle durch elektrophoretische Puffer wieder von den Beads ablösen.
Carpio, A., Mercader-Trejo, F., Arce, L., & Valcárcel, M. (2012). Use of carboxylic group functionalized magnetic nanoparticles for the preconcentration of metals in juice samples prior to the determination by capillary electrophoresis: CE and CEC. ELECTROPHORESIS, 33(15), 2446–2453. https://doi.org/10.1002/elps.201100636
Lectine lassen sich kovalent an MagSi-S Tosyl 1.0 Beads koppeln, um Glycoproteine aufreinigen.
Engel, N. Y., Weiss, V. U., Wenz, C., Glück, S., Rüfer, A., Kratzmeier, M., Marchetti-Deschmann, M., & Allmaier, G. (2017). Microchip capillary gel electrophoresis combined with lectin affinity enrichment employing magnetic beads for glycoprotein analysis. Analytical and Bioanalytical Chemistry, 409(28), 6625–6634. https://doi.org/10.1007/s00216-017-0615-0
Auch Enzyme können auf Magnetic Beads immobilisiert werden, z.B. für Untersuchungen von Kinetiken oder Funktionsexperimenten.
Huang, S., Celá, A., Adams, E., Glatz, Z., & Van Schepdael, A. (2020). Aldehyde oxidase assay by capillary electrophoresis: From off‐line, online up to immobilized enzyme reactor. Journal of Separation Science, 43(17), 3565–3572. https://doi.org/10.1002/jssc.202000412
Oligonukleotide können an die Beads (z.B. MagSi-S NH2, MagSi-S CHO) kovalent gebunden werden und so für Capture-Assays oder die spezifische Anreicherung von Targets genutzt werden.
Auch für diagnostische Zwecke sind Magnetic Beads perfekt geeignet. Sie werden häufig eingesetzt zur Detektion von Viren, spezifischen Proteinen, oder Zellen.
Details der MagSi-S Tools Beads .
Übersicht der funktionellen Oberflächen .
| MagSi-S Bead | Oberfläche | Struktur | Zielmolekül | Anwendung |
|---|---|---|---|---|
| MagSi-S (Silica) | – | R-OH | Individuelle Funktionalisierung | |
| MagSi-S CHO (Aldehyd) | Aldehyd | R-CHO | NH2 (Amin) | Immobilisierung von Proteinen |
| MagSi-S COOH (Carboxyl) | Carboxyl | R-COOH | NH2 (Amin); Lysin, Cystein, Histidin, Tyrosin | Immobilisierung von Peptiden, Proteinen, Antikörpern |
| MagSi-S Epoxy | Epoxy |  | NH2 (Amin); Lysin, Cystein, Histidin, Tyrosin | Immobilisierung von Enzymen, Peptiden und Proteinen |
| MagSi-S Hydrazide | Hydrazid | R-CO-N2H2 | Oligosacharidketten | Immobilisierung von Antikörpern, Peptiden, Proteinen und Glycoproteinen |
| MagSi-S NH2 (Amin) | NH2 | R-NH2 | Amine, Aldehyde | Immobilisierung von Proteinen |
| MagSi-S SH (Sulfydryl) | SH | R-SH | Freies Cystein | Immobilisierung von Molekülen via Cystein-Gruppen und Immobiliserung an Goldoberflächen |
| MagSi-S Tosyl | Tosyl | 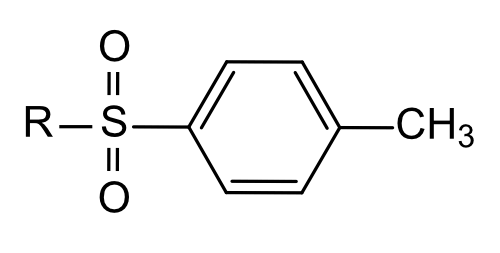 | SH (Sulfhydryl) und NH2 (Amin) | Immobilisierung von Antikörpern, Peptiden und Proteinen |
Kopplungschemien unterschiedlicher Beads .
| Bead Oberfläche | Benötigte Chemikalien | Protein binding | Treatment | Kommentare |
|---|---|---|---|---|
| Carboxyl [1] (COOH) | EDC / NHS | Amingruppen (von Lysin und/oder als unblockierte N-Termini) Lysin, Histidin, Cystein, Tyrosin usw. | Kein Treatment nötig | Kann für die meisten Proteine zur Kopplung benutzt werden. |
| Aldehyd (CHO) | Aldehyd/Amin Reaktion | Amingruppen | Kein Treatment nötig | Reduktionsmittel hinzufügen zur Stabilisierung der Amidbindung. |
| Thiol (SH) | Redox Reaktion [3] | Freies Cystein | Reduzieren von Disulfiden unter nicht denaturierenden Bedingungen zur Erzeugung von freiem Cystein | Nützlich für Cystein-haltige Proteine. Multiple Kopplung möglich. |
| Amin [2] (NH2) | Gluteraldehyd | Amin/Aldehyd | Kein Treatment nötig | Reduktionsmittel hinzufügen zur Stabilisierung der Amidbindung. |
| Tosyl | Keine | Sulfhydryl, Amingruppen | Kein Treatment nötig | Nützlich für Antikörper. |
| Hydrazid | Natrium Perodiat | Oligosaccharid-Gruppen | Oxidieren von Glykoproteinen unter nicht denaturierenden Bedingungen | Nützlich für Glykoproteine. |
| Epoxy | Adsorption / Reaktionsunterstützung | Lysin, Histidin, Cystein, Tyrosin usw. | Kein Treatment nötig | Nützlich für Enzyme. |
[2] Gluteraldehyd führt zu einer stabileren Proteinbindung als die Carbodiimid-Reagenzien, die mit Carboxylat-Beads verwendet werden.
[3] Reduktion der Disulfide mit 0,1 M DTE (Dithioerythrol); Kopplung des Proteins bei einem pH-Wert unterhalb des isoelektrischen Punkts; Deaktivierung des überschüssigen Thiols mit 20 mM PDEA (2-(2-Pyridinyldithio)ethan-Amin)/ 1M NaCl, pH 4,3
Abkürzungen: EDC, N-Ethyl-N’-(dimethylaminopropyl)carbodiimid; NHS, N-Hydroxysuccinimid.
Technische Daten .
| MagSi-S Tools 600 | MagSi-S Tools 1.0 | MagSi-S Tools 3.0 | |
|---|---|---|---|
| Größe | 600 nm | 1,0 µm | 3,0 µm |
| Konzentration | 10 mg/ml | ||
| Beads/ml | 8 – 20 * 10^9 | 6 – 12 * 10^9 | 1 – 3 * 10^9 |
| Produktvolumen | 2 ml, 10 ml, 100 ml | ||
| Material | Magentische Silica-Beads mit aktivierter Oberfläche | ||
| Magentischer Gehalt | 40% | 60% | 60% |
| Größenverteilung (D5 – D95) | 500 – 900 nm | 0,7 – 1,4 µm | 0,6 – 10,0 µm |
| Pufferlösung | MagSi-Tools, oberflächenaktiviert: PBS (pH 7,4), 0,05% Natriumazid (NaN3, Toxisch!), außer: 1) MagSi-S, unmodifizierte Silica-Beads und MagSi-S NH2, Amin-modifizierte Silica-Beads: Wasser, 0,05% Natriumazid 2) Epoxy- und Tosyl-aktivierte Beads werden werden in DSMO:THF 1:1 geliefert. | ||
| Lagerung | bei 2 – 8°C |
MagSi-S Beads .
Magnetische Siliziumdioxidpartikel für die eigene Entwicklung.
MagSi-S COOH Beads .
MagSi-S Tosyl Beads .
Magnetische Siliziumdioxidpartikel mit Tosyl-modifizierter Oberfläche. Bestimmt für die Tosyl-Kopplungschemie mit Antikörpern und Proteinen.
| Artikelnummer | Volumen | Produkt | Konzentration | Größe |
|---|---|---|---|---|
| MD16008 | 2 mL | MagSi-S Tosyl 600 | 10 mg/mL | 600 nm |
| MD18008 | 10 mL | |||
| MD19008 | 100 mL | |||
| MD01008 | 2 mL | MagSi-S Tosyl 1.0 | 10 mg/mL | 1,0 µm |
| MD03008 | 10 mL | |||
| MD04008 | 100 mL | |||
| MD41008 | 2 mL | MagSi-S Tosyl 3.0 | 10 mg/mL | 3,0 µm |
| MD43008 | 10 mL | |||
| MD44008 | 100 mL |
MagSi-S NH2 Beads .
MagSi-S SH Beads .
Magnetische Siliziumdioxidpartikel mit modifizierter Oberfläche für die SH-Kopplungschemie.
MagSi-S CHO Beads .
MagSi-S Hydrazide Beads .
Magnetische Siliziumdioxidpartikel mit Hydrazid-modifizierter Oberfläche. Vorgesehen für die Immobilisierung von Antikörpern, Glykoproteinen oder anderen aldehydhaltigen Molekülen.
| Artikelnummer | Volumen | Produkt | Konzentration | Größe |
|---|---|---|---|---|
| MD16013 | 2 ml | MagSi-S Hydrazide 600 | 10 mg/ml | 600 nm |
| MD18013 | 10 ml | |||
| MD19013 | 100 ml | |||
| MD01013 | 2 ml | MagSi-S Hydrazide 1.0 | 10 mg/ml | 1,0 µm |
| MD03013 | 10 ml | |||
| MD04013 | 100 ml | |||
| MD41013 | 2 ml | MagSi-S Hydrazide 3.0 | 10 mg/ml | 3,0 µm |
| MD43013 | 10 ml | |||
| MD44013 | 100 ml |
MagSi-S Epoxy Beads .
Magnetische Siliziumdioxidpartikel mit Epoxid-modifizierter Oberfläche. Vorgesehen für die Kopplung an Enzyme und andere NH2-haltige Moleküle.
| Artikelnummer | Volumen | Produkt | Konzentration | Größe |
|---|---|---|---|---|
| MD16010 | 2 ml | MagSi-S Epoxy 600 | 10 mg/ml | 600 nm |
| MD18010 | 10 ml | |||
| MD19010 | 100 ml | |||
| MD01010 | 2 ml | MagSi-S Epoxy 1.0 | 10 mg/ml | 1,0 µm |
| MD03010 | 10 ml | |||
| MD04010 | 100 ml | |||
| MD41010 | 2 ml | MagSi-S Epoxy 3.0 | 10 mg/ml | 3,0 µm |
| MD43010 | 10 ml | |||
| MD44010 | 100 ml |
MagSi-S funktionelle Beads .
Downloads .
Carpio, A., Mercader-Trejo, F., Arce, L., & Valcárcel, M. (2012). Use of carboxylic group functionalized magnetic nanoparticles for the preconcentration of metals in juice samples prior to the determination by capillary electrophoresis: CE and CEC. ELECTROPHORESIS, 33(15), 2446–2453. https://doi.org/10.1002/elps.201100636
Engel, N. Y., Weiss, V. U., Wenz, C., Glück, S., Rüfer, A., Kratzmeier, M., Marchetti-Deschmann, M., & Allmaier, G. (2017). Microchip capillary gel electrophoresis combined with lectin affinity enrichment employing magnetic beads for glycoprotein analysis. Analytical and Bioanalytical Chemistry, 409(28), 6625–6634. https://doi.org/10.1007/s00216-017-0615-0
Huang, S., Celá, A., Adams, E., Glatz, Z., & Van Schepdael, A. (2020). Aldehyde oxidase assay by capillary electrophoresis: From off‐line, online up to immobilized enzyme reactor. Journal of Separation Science, 43(17), 3565–3572. https://doi.org/10.1002/jssc.202000412

